Esta publicação também está disponível em:


Quase 12 anos após a descoberta da técnica de edição gênica in vivo, pelas Dra. Jennifer Doudna e Dra. Emmanuelle Charpentier (ganhadoras do Nobel de Química em 2020), finalmente a Food and Drug Administration (FDA) dos EUA aprovou dois tratamentos com perspectiva. Casgevy e Lyfgenia são as primeiras terapias genéticas baseadas em células para o tratamento da Anemia Falciforme aprovadas para pacientes com 12 anos ou mais. Especificamente, Casgevy, é o primeiro tratamento aprovado pela FDA a utilizar uma nova tecnologia de edição de genoma pelo método CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats), sinalizando um avanço inovador no campo da terapia genética.
Definição
Resumidamente, CRISPR representa um conjunto de repetições palindrômicas em associação com as nucleases Cas – sendo a Cas9 a mais famosa, que funcionam como “tesouras moleculares”. Essas enzimas têm a capacidade de editar (remover, adicionar, trocar) sequências de DNA localizadas em qualquer região do genoma.
A Origem
A técnica é baseada em um sistema de memória imunológica presente nas bactérias. As bactérias usam CRISPR para se defenderem de vírus. Elas fazem isso capturando e incorporando sequências de DNA do vírus invasor em seu próprio genoma em locais CRISPR. Essas sequências capturadas servem como um “banco de memória” que as bactérias usam para reconhecer e combater o mesmo vírus no futuro.
Como funciona no homem?
Cientistas adaptaram esse sistema para editar genomas de maneira precisa e eficiente. Conhecendo previamente uma sequência no DNA que se quer modificar (como, por exemplo, uma variante que causa uma doença), eles podem sintetizar um “RNA guia” para se ligar (se complementar) a essa região específica. A enzima Cas9 (“tesoura”) combinada ao RNA guia faz um corte no DNA, permitindo que cientistas removam, alterem ou substituam sequências de DNA específicas.
Vejam: este sistema CRISPR/Cas9 é capaz de reparar, silenciar e reprimir genes, entre outras alterações genômicas. Esta forma de edição pode ser utilizada na edição/remoção de oncogenes e proto-oncogenes, imunoterapia, em associação à terapia antirretroviral no HIV (LASER ART 2019) e, claro, nas doenças genéticas (Distrofia Muscular de Duchenne, Hemofilia, Deficiência da alfa1-antitripsina, Cardiomiopatia Hipertrófica e etc).
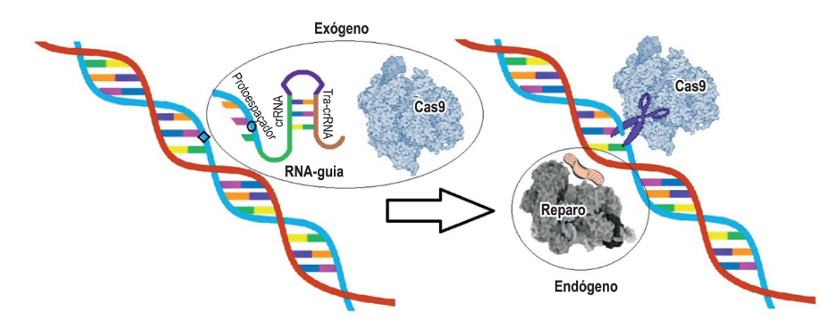

Figura. Sistema CRISPR/Cas9 – mecanismo de reconhecimento do alvo. O RNA guia é projetado para reconhecer a sequência-alvo a ser modificada no DNA e introduzir modificações. Quando o pareamento de bases nitrogenadas ocorre algumas modificações são adicionadas (aqui, representadas pelo círculo) e a enzima Cas9 é acionada, causando quebras na dupla-fita de DNA. As quebras ativam os sistemas de reparo intracelulares que refazem a dupla-fita, aceitando as modificações oriundas do RNA guia, e então há o reparo do DNA com surgimento de novas variantes. (Adaptado de: Arend MC et al, 2017)
Falando sobre as novas descobertas, o Casgevy modifica as células-tronco hematopoiéticas dos pacientes com anemia falciforme pela edição do genoma usando a tecnologia CRISPR/Cas9. As células-tronco sanguíneas modificadas são transplantadas de volta para o paciente, onde se fixam e se multiplicam na medula óssea aumentando a produção de hemoglobina fetal saudável que previne a falcização.
Já com a Lyfgenia, as células-tronco do sangue do paciente são geneticamente modificadas para produzir HbAT87Q, que funciona de forma semelhante à hemoglobina A (hemoglobina adulta normal). Os glóbulos vermelhos contendo HbAT87Q apresentam menor risco de falcização e obstrução do fluxo sanguíneo.
Ambos os produtos são feitos a partir de células-tronco do próprio sangue dos pacientes, que são modificadas e são devolvidas como uma infusão única de dose única como parte de um transplante de células-tronco hematopoéticas.
Mas e a Cardiologia?
Já existem várias iniciativas em andamento, principalmente no campo da Cardiomiopatia Hipertrófica (Strong A, 2023), Amiloidose Transtirretina (Gillmore JD et al, 2021) e na Hipercolesterolemia familiar (Kosmas CE et al, 2022).
No último congresso AHA 2023, foram apresentados os resultados do ensaio VERVE-101. Este estudo envolveu 10 pacientes (8 homens/2 mulheres, idade média de 54 anos) com Hipercolesterolemia familiar heterozigótica (HFHe) e LDL-C médio de 201 mg/dL. A maioria dos participantes tinha doença arterial coronariana grave pré-existente e havia sido submetida a revascularização coronariana prévia. Nove dos 10 pacientes estavam usando estatinas.
Todos os pacientes receberam uma única infusão intravenosa de VERVE-101, em diferentes doses, de 0,1 mg/kg até 0,6mg/kg (dose máxima). Os resultados gerais mostraram que três pacientes que receberam as duas doses mais altas de VERVE-101 (0,45 mg/kg e 0,6 mg/kg) observaram as maiores reduções nos níveis de proteína LDL-C e PCSK9. Os dois pacientes no grupo de 0,45 mg/kg observaram reduções no LDL-C em 39% e 48%, respectivamente, e na PCSK9 em 47% e 59%. O único paciente do grupo 0,6mg/kg apresentou uma redução no LDL-C de 55% e no PCSK9 de 84%. As reduções no LDL tem se sustentado até o último follow-up de 6 meses.
Essas estratégias emergentes de edição gênica abriram as portas para soluções terapêuticas de longo prazo que estão no caminho certo para revolucionar alguns tratamentos na medicina. No entanto, uma vez que estes tratamentos resultam em alterações permanentes no genoma do paciente, será fundamental determinar o perfil de segurança agudo, intermédio e a longo prazo in vivo em humanos.
Veja mais detalhes do estudo VERVE-101 aqui!
Desafios e considerações éticas
CRISPR é uma técnica revolucionária de edição genética, traz a descoberta de proteínas “tesoura” Cas que juntas com RNA guia reconhecem o local a ser abordado; e como o RNA guia é sintetizado no laboratório, as possibilidades de edição são praticamente infinitas.
Mas como nem tudo que parece mel é doce, temos que lembrar que apesar da segurança e eficácia terem sido já avaliadas em curto prazo, é necessária a avaliação de longo prazo. Além disso, há o desafio de garantir a precisão e minimizar as edições “off-target” (em locais errados do genoma), um importante fator limitante do uso do CRISPR/Cas9 in vivo em humanos.
Além disso, há importantes considerações éticas, especialmente em relação à edição de genes em embriões humanos ou alterações que podem ser passadas para as próximas gerações.
(com contribuições do Editor)
Referências:
Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17;337(6096):816-21. doi: 10.1126/science.1225829. Epub 2012 Jun 28. PMID: 22745249; PMCID: PMC6286148.
Dash, P.K., Kaminski, R., Bella, R. et al. Sequential LASER ART and CRISPR Treatments Eliminate HIV-1 in a Subset of Infected Humanized Mice. Nat Commun 10, 2753 (2019).
Arend MC, Pereira JO, Markoski MM. The CRISPR/Cas9 System and the Possibility of Genomic Edition for Cardiology. Arq Bras Cardiol [Internet]. 2017Jan;108(1):81–3. Available from: https://doi.org/10.5935/abc.20160200.
Sganzerla A, Pessini L. Edição de humanos por meio da técnica do Crispr-cas9: entusiasmo científico e inquietações éticas. Saúde debate [Internet]. 2020Apr;44(125):527–40. Available from: https://doi.org/10.1590/0103-1104202012519.
Tisdale JF, Pierciey FJ, Bonner M, et al. (2020) Safety and feasibility of hematopoietic progenitor stem cell collection by mobilization with plerixafor followed by apheresis vs bone marrow harvest in patients with sickle cell disease in the multi-center HGB-206 trial. Am J Hematol E239–E242. https://doi.org/10.1002/ajh.25867.
Frangoul H, Altshuler D, Cappellini MD, Chen YS, Domm J, Eustace BK, Foell J, de la Fuente J, Grupp S, Handgretinger R, Ho TW, Kattamis A, Kernytsky A, Lekstrom-Himes J, Li AM, Locatelli F, Mapara MY, de Montalembert M, Rondelli D, Sharma A, Sheth S, Soni S, Steinberg MH, Wall D, Yen A, Corbacioglu S. CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. N Engl J Med. 2021 Jan 21;384(3):252-260. doi: 10.1056/NEJMoa2031054. Epub 2020 Dec 5. PMID: 33283989.
Strong A. CRISPR gene-editing therapies for hypertrophic cardiomyopathy. Nat Med. 2023 Feb;29(2):305-306. doi: 10.1038/s41591-022-02184-5. PMID: 36797479; PMCID: PMC9969544.
Chan DC, Watts GF. The Promise of PCSK9 and Lipoprotein(a) as Targets for Gene Silencing Therapies. Clin Ther. 2023 Nov;45(11):1034-1046. doi: 10.1016/j.clinthera.2023.07.008. Epub 2023 Jul 29. PMID: 37524569.
Gillmore JD, Gane E, Taubel J, Kao J, Fontana M, Maitland ML, Seitzer J, O’Connell D, Walsh KR, Wood K, Phillips J, Xu Y, Amaral A, Boyd AP, Cehelsky JE, McKee MD, Schiermeier A, Harari O, Murphy A, Kyratsous CA, Zambrowicz B, Soltys R, Gutstein DE, Leonard J, Sepp-Lorenzino L, Lebwohl D. CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. N Engl J Med. 2021 Aug 5;385(6):493-502. doi: 10.1056/NEJMoa2107454. Epub 2021 Jun 26. PMID: 34215024.
A Study of VERVE-101 in Patients With Familial Hypercholesterolemia and Cardiovascular Disease .